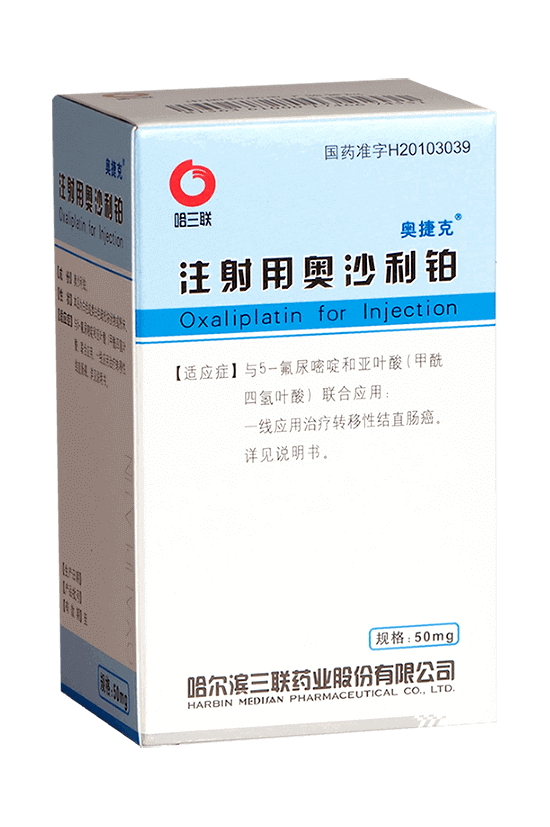
| 藥品名稱 | 注射用奧沙利鉑 |
|---|---|
| 商品名 | 奧捷克 |
| 英文名 | Oxaliplatin for Injection |
| 醫保種類 | 乙類 |
| 國家基藥 | 是 |
| 批準文號 | 國藥準字H20103039 |
| 包裝規格 | 50mg×1瓶/盒 |
| 適應癥 | 與5-氟尿嘧啶和亞葉酸(甲酰四氫葉酸)聯合應用:一線應用治療轉移性結直腸癌、輔助治療原發腫瘤完全切除后的IlI期 (Duke's C期)結腸癌 |
請仔細閱讀說明書并在醫師指導下使用。
警示語:奧沙利鉑過敏者禁用;哺乳期婦女禁用;有嚴重腎功能不全者禁用。
1?劑量:
限成人使用。
輔助治療時,奧沙利鉑的推薦劑量為85 mg/m2 (靜脈滴注)每2周重復,共12個周期(6個月)。
治療轉移性結直腸癌,奧沙利鉑的推薦劑量為85mg/m2 (靜脈滴注) 每2周重復一次或130mg/m2,每3周一次,或遵醫囑使用。奧沙利鉑主要用于以5-氟尿嘧啶持續輸注為基礎的聯合方案中。
應按照病人的耐受程度進行劑量調整(見【注意事項】中“特殊警告和特殊使用注意事項”)。
2?危險人群:
腎功能不全者:
目前尚無奧沙利鉑用于嚴重腎功能不全患者的資料(見【禁忌】)。中度腎功能不全者,開始治療時可給予推薦的劑量(見【注意事項】中“特殊警告和特殊使用注意事項”。對于輕度腎功能不全者,無需調整劑量。
肝功能不全者:
對于有嚴重肝功能不全者,奧沙利鉑應用尚無研究。對于治療開始時肝功能檢查不正常的患者人群,應用奧沙利鉑,未出現急性毒性的增加。在臨床研究中,對肝功能異常者不需要進行特別的劑量調整。
3?用法:
奧沙利鉑用于靜脈滴注。
奧沙利鉑使用時無需水化。
將奧沙利鉑溶于5%葡萄糖溶液250-500ml(以便達到0.2mg/ml以上的濃度),通過外周或中央靜脈滴注2-6小時。奧沙利鉑必須在5-氟尿嘧啶前滴注。如果漏于血管外,必須立即終止給藥。
4?使用指導:
奧沙利鉑必須在使用前配制和進一步稀釋。必須用規定的溶液來溶解和稀釋凍干粉制劑。
5?使用操作說明:
像其他細胞毒藥物一樣,使用和配制奧沙利鉑必須遵照注意事項小心謹慎地進行。
6?操作指導:
醫務人員和護士在處置這一細胞毒藥物時,在每一個步驟都應謹慎操作,以保證自己和周圍環境的安全。
7?使用時的特殊注意事項:
不得使用含鋁的注射材料
未經稀釋不得使用
不得用鹽溶液配制或稀釋本品
不要與其它任何藥物混合或經同一個輸液通道同時使用,(特別是5-氟尿嘧啶,堿性溶液,氨丁三醇,和含輔料氨丁三醇的亞葉酸類藥品)。奧沙利鉑輸完后需沖洗輸液管道。
奧沙利鉑與亞葉酸可通過在注射部位前使用Y型輸液管連接器同時給予,置Y形管于緊靠靜脈穿刺端,但是兩種藥物不能混入同一個輸液袋中。
亞葉酸必須用等滲溶液,如5%葡萄糖,配制輸注液,不要用鹽或堿溶液。
輸注奧沙利鉑前,需沖洗輸液管。
只能使用推薦的溶劑(見后)。
如果配制的溶液中有任何沉淀物,都不能再使用,且應該按照法規要求對危險品的處理原則進行銷毀。
8?溶液的配制:
配制溶液時應使用注射用5%葡萄糖溶液。
50mg包裝需加入10ml溶劑,使奧沙利鉑濃度達到5.0mg/ml。
0.1g包裝需加入20ml溶劑,使奧沙利鉑濃度達到5.0mg/ml。
從微生物學和化學角度,配制的溶液必須立即用5%葡萄糖溶液稀釋。
使用前應檢查其透明度,只有澄清的沒有沉淀的溶液才能使用。
本品為單次使用,任何剩余的溶液應丟棄掉。
9?注射前稀釋:
從瓶中取出配制的溶液,立即用250-500ml的5%的葡萄糖溶液稀釋成0.2mg/ml以上濃度的溶液,然后靜脈輸注。
從微生物學角度看,此溶液應立即使用。本品配伍穩定性試驗顯示在室溫條件下放置6小時保持穩定。
使用前應檢查其透明度,只有澄清而無沉淀的溶液才能使用。
本品為單次使用,任何剩余的溶液應丟棄掉。
不得用鹽溶液配制和稀釋本品。
10?輸注:
奧沙利鉑應用時不需要預先水化。
奧沙利鉑用250-500ml的5%的葡萄糖溶液稀釋成0.2mg/ml以上濃度的溶液,必須通過外周或中央靜脈滴注2-6小時。
當奧沙利鉑與5-氟尿嘧啶合用時,奧沙利鉑應先于5-氟尿嘧啶使用。
11?廢棄物處理:
任何剩余藥品,以及用于配制、稀釋和注射用的所有物品,必須按照細胞毒藥物的標準醫院程序和毒性廢棄物處理的現行法律規定進行銷毀。
以下來自國外臨床研究資料。
奧沙利鉑與5-氟尿嘧啶/亞葉酸聯合使用期間,可觀察到的最常見的不良反應為:胃腸道(腹瀉,惡心,嘔吐以及黏膜炎)、血液系統(中性粒細胞減少,血小板減少)以及神經系統反應(急性,劑量累積性,外周感覺神經病變)。總體上,這些不良反應在奧沙利鉑與5-氟尿嘧啶/亞葉酸聯合使用時比單獨使用5-氟尿嘧啶/亞葉酸時更常見、更嚴重。下列表格中顯示的不良反應發生率數據來自國外轉移癌治療和輔助治療所進行的臨床研究(奧沙利鉑與5-氟尿嘧啶/亞葉酸聯合治療組分別包括416和1108例患者),以及來自上市后經驗。
表格中顯示的不良反應發生率是采用下列標準定義的:很常見(>l/10),常見(>1/100,<1/10),不常見(>1/1000,<1/100),少見(>1/10000,<1/1000)以及極少見(<1/10000),包括個例。
表格后給出了更詳細的信息。
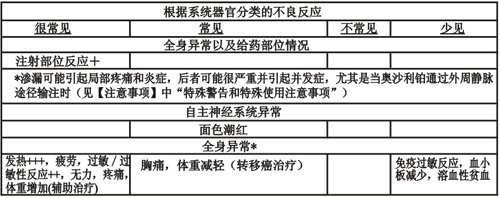
*詳見下面部分。
**見【注意事項】中“特殊警告和特殊使用注意事項”。
肝膽異常
極少數(≤1/10000):肝竇阻塞綜合征,又稱為肝靜脈阻塞性疾病,或與此類癥狀相關的包括紫癜性肝病、肝結節狀再生性增生和竇周纖維化在內的組織學異常。因此,臨床表現可能包括門靜脈高壓癥和/或轉氨酶升高。
血液學毒性作用
奧沙利鉑單藥(130mg/m2每3周重復)發生各級別毒性的患者百分率。
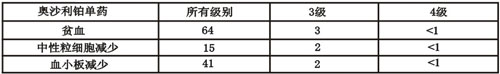
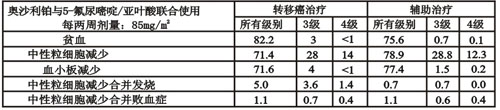
奧沙利鉑與5-氟尿嘧啶/亞葉酸聯合使用發生各級別毒性的患者百分率。
消化系統毒性
奧沙利鉑單藥(130mg/m2每3周重復)發生各級別毒性的患者百分率。
奧沙利鉑與5-氟尿嘧啶/亞葉酸聯合使用發生各級別毒性的患者百分率。
需要使用有效的止吐藥進行預防和/或治療。
嚴重的腹瀉和/或嘔吐可能引起脫水,麻痹性腸梗阻,小腸阻塞,低鉀血癥,代謝性酸中毒和肝臟功能的損害,尤其當奧沙利鉑與5-氟尿嘧啶聯合使用時(見【注意事項】中“特殊警告和特殊使用注意事項”)。
神經系統
奧沙利鉑的劑量限制性毒性反應是神經系統毒性反應。主要表現在外周感覺神經病變,表現為肢體末端感覺障礙或/和感覺異常。伴或不伴有痛性痙攣,通常遇冷會激發。這些癥狀在接受治療的病人中的發生率為95%。在治療間歇期,癥狀通常會減輕,但隨著治療周期的增加,癥狀也會逐漸加重。
病人癥狀持續的時間,疼痛和/或功能障礙的發生程度是進行劑量調整的指征,甚至有時需要終止治療(見【注意事項】中“特殊警告和特殊使用注意事項”)。
功能障礙包括不能完成精細動作,這種癥狀可能與感覺障礙有關。當累積劑量接近850mg/m2(或10個周期)時,出現持續癥狀的危險性接近10%,當累積劑量約為1000mg/m2(或12個周期)時,可達20%。當治療停止后,神經系統癥狀通常可以改善。
在大多數情況下,神經系統的癥狀和體征在治療停止后可以得到改善或完全消退。
在結腸癌的輔助治療中,治療終止6個月后,87%患者不再有任何癥狀或者僅有中度癥狀。在超過3年的隨訪后,大約3%的患者仍存在持續的、中度的感覺異常(2.3%)或者仍有可能影響日常活動的感覺異常(0.5%)。
已有關于應用奧沙利鉑后出現急性神經感覺癥狀的報道(見【藥理毒理】中“臨床前安全性研究資料”)。這些癥狀通常在服藥后幾小時內出現,多發于遇冷空氣時。癥狀特征表現為一過性感覺異常、感覺遲鈍或感覺減退,或有可能發生急性咽喉感覺異常綜合癥。該綜合癥(其發生率約為1%和2%)主要特征是伴有吞咽困難和呼吸困難的主觀感覺,但并無任何呼吸困難的客觀征象(無發紺和缺氧癥發生),也不伴有喉痙攣或支氣管痙攣(無哮嗚和喘鳴)。也曾報道出現頜痙攣、舌部感覺異常以及隨后可能出現的語言障礙和胸悶等癥狀。
雖然發生以上癥狀時,可以給予抗組胺藥和支氣管擴張劑,但即使不做任何處理,這些癥狀也可以迅速逆轉。在以后的治療中延長輸注時間可以減少癥狀的發生率(見【注意事項】中“特殊警告和特殊使用注意事項”)。
奧沙利鉑治療期間還有其它神經學上的癥狀——如發音困難、腱反射消失及Lhermitte’s征等的報道。還有視神經炎的個例報道。
過敏反應
根據患者(%)和級別的發生率。

奧沙利鉑禁用于以下病人。
已知對奧沙利鉑過敏者。
哺乳期婦女。
在第l療程開始前已有骨髓抑制者,如:中性粒細胞計數<2×109/L和/或血小板計數<100109/L。
在第1療程開始前有周圍感覺神經病變伴功能障礙者。
有嚴重腎功能不全者(肌酐清除率低于30ml/min)。